Ozone
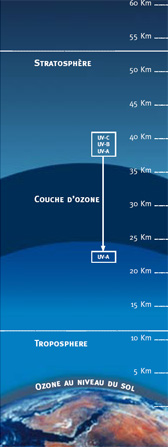
L’ozone est un gaz: une molécule d’ozone est composée de trois atomes d’oxygène. Le symbole chimique est simple: O3. L’ozone altère notre environnement, mais il n’est pas si simple de l’éviter. La pollution de l’air est la cause principale de la formation de l’ozone. Par temps chaud, le soleil en rayonnant sur un “cocktail” de gaz polluants provoque la formation de l’ozone. Mais la présence de l’ozone nuisible dans notre environnement (ozone troposphérique) ne doit pas être confondue avec le célèbre “trou dans la couche d’ozone” (ozone stratosphérique). L’ozone stratosphérique existe naturellement dans notre atmosphère entre 20 et 40 kilomètres d’altitude: c’est la fameuse “couche d’ozone”. Cet ozone est vital car il retient la plus grande partie des rayons ultraviolets nuisibles émis par le soleil. Sa présence nous protège des effets nocifs des rayons ultraviolets émis par le soleil. L’ozone troposphérique est celui que l’on trouve à moins de 10 kilomètres de la couche terrestre. Cet ozone-là est au contraire nuisible à notre santé.
Sommaire
Couche d'Ozone
( Ozone stratosphérique)
Processus de formation
L'ozone est produit à partir du dioxygène, composé de deux atomes d'oxygène.
Aux altitudes supérieures à 30 km, le rayonnement solaire possède encore une énergie suffisante pour casser une partie des molécules d'oxygène et libérer les atomes. Un atome d'oxygène tendant à ne pas rester seul pour des raisons de stabilité, doit se recombiner à un autre élément ; il interagit donc avec une autre molécule d'oxygène (O2) présente pour former une nouvelle molécule, composée de trois atomes d'oxygène : l'ozone (O3).
- O2 + hv -> O + O
(Le rayonnement solaire qui permet la photodissociation est de longueur d'onde inférieure à 242nm : des UV essentiellement, les EUV ayant déjà été absorbés par l'ionosphère)
L'atome d'oxygène peut ensuite se combiner avec une molécule d'oxygène pour créer une molécule d'ozone:
- O + M -> O3 + M
ou M représente O2 ou N2 et intervient en tant que catalyseur. La molécule d'ozone peut enfin se dissocier en absorbant un rayonnement de longeur d'onde comprise entre 240 nm et 310 nm.
Cette réaction chimique est la seule qui, dans la stratosphère, produise de l'ozone.
Mais puisqu'il y demeure encore de l'oxygène, c'est qu'il existe un facteur limitant sa concentration. Primitivement, une certaine quantité d'ozone s'est formée il y a environ deux milliards d'années et elle constitue le réservoir d'ozone de l'atmosphère. La concentration observée aujourd'hui résulte d'un équilibre entre la production d'ozone par le rayonnement solaire et certains processus de destruction : tout l'ozone produit en «trop plein du réservoir» est détruit. C'est ce que l'on appelle un équilibre dynamique.
Un équilibre dynamique
Le jour, à haute altitude, le rayonnement solaire peut dissocier la molécule d'ozone en une molécule de dioxygène et un atome d'oxygène :
- O3 + rayonnement -> O2 + O
Durant la nuit et en particulier la nuit polaire, cette réaction n'existe pas puisqu'il n'y a plus de rayonnement solaire. Une autre réaction devient alors prépondérante : la recombinaison d'un atome d'oxygène et d'une molécule d'ozone pour donner deux molécules de dioxygène :
- O3 + O -> 2 O2
Mais l'ensemble de ces deux réactions ne peut rendre compte que de 20 % de la destruction naturelle de l'ozone, alors que pour parvenir à un équilibre il faut que la perte soit égale à la production. Ce problème met en évidence la fragilité de l'équilibre de l'ozone. En effet, si les deux réactions ci-dessus avaient pu suffire à compenser la surproduction d'ozone, l'équilibre de ce dernier ne dépendrait que de la quantité de dioxygène présent dans la haute atmosphère, et cet équilibre aurait été difficilement perturbable, mais les composés chlorés perturbent cet équilibre. Les composés bromés, et les oxydes d'azotes (NOx) contribuent également à cette destruction.
L'action des composés chlorés
Parvenues dans la stratosphère, les molécules de composés chlorés sont décomposées par le rayonnement solaire, les produits de cette décomposition détruisant les molécules d'ozone par le jeu de réactions catalytiquesTemplate:Refl.
Les sources naturelles de chlore
La seule source naturelle de chlore est le chlorure de méthyle, principalement produit dans les océans par les micro-organismes, les algues. La concentration ne dépasse pas 0,6 milliardième : c'est à cela que se limite le fonds naturel de chlore dans l'atmosphère.
Les chlorofluorocarbures
Inventés dans les années 1930, les chlorofluorocarbures ont connu un développement important à partir des années 1950 à cause de leurs propriétés remarquables (ininflammables, facilement compressibles, non solubles) et, comme ils n'ont qu'une faible réactivité chimique, on les croyait peu toxiques pour l'environnement. Utilisés principalement dans l'industrie du froid, les bombes aérosols, les solvants pour l'industrie électronique, les mousses synthétiques et les agents extincteurs, ils sont essentiellement dus à l'activité humaine.
La production des CFC est très importante. Pour les deux principaux, le trichlorofluorométhane (CFC 11) et le dichlorofluorométhane (CFC l2), la production est passée de 50 000 à 100 000 t au début des années 1960 jusqu'à 500 000 t en 1999. Cela représente une croissance de 5 à 6 % par an, soit pratiquement un doublement de la quantité tous les dix ans.
Diffusion dans l'atmosphère
Les vents brassent l'atmosphère en permanence :
- horizontalement, avec un temps moyen de transport d'un pôle à l'autre de l'ordre de deux ou trois ans.
- verticalement, avec une homogénéisation de l'atmosphère jusqu'à 80 km d'altitude.
En deux à trois ans, les CFC se retrouvent donc dans l'atmosphère sous toutes les latitudes, aussi bien à l'équateur qu'aux pôles. Puis, en quinze ans, ils montent dans la haute atmosphère.
Accumulation dans la stratosphère
À cela s'ajoute un autre effet. Les CFC présents dans la stratosphère en 1997 sont ceux qui ont été produits entre 1977 et 1982, ce qui ne représente que 40 % de ce qui a été produit jusqu'à ce jour.
Les 60 % restants sont encore en train de se mélanger et de monter. Il y a donc un retard et, les effets des CFC produits ces dernières années se feront encore sentir dans 50 ans.
Trou d'Ozone
L'affaiblissement de la couche d'ozone provoquée par les réactions avec les CFC produisent des zones lacunaires, dans lequel l'Ozone se trouve en quantité très réduite.
L'ozone est aujourd'hui observé par un réseau de stations au sol et au moyen de satellites artificiels.
C'est en 1985 que l'alerte a été donnée avec la découverte d'une diminution importante de la concentration d'ozone au cours des mois de septembre et d'octobre au-dessus du continent antarctique. Il s'agit en effet d'une réduction de près de 50 % du contenu total d'ozone, se produisant au cours du printemps austral et s'étendant sur toute la surface de l'antarctique.
Effet du trou d'Ozone
Voir les effets des rayons ultraviolets.
Ozone d'origine anthropique
(Ozone troposphérique) Cet ozone ne se trouve pas dans la haute atmosphère mais plus près du sol. Il est un polluant secondaire, c'est-à-dire, qu'il est formé par des processus chimiques complexes à partir d'autres polluants, appelés précurseurs. Cette caractéristique rend la lutte contre la pollution par l'ozone difficile et diminuer la pollution pour un polluant précurseur peut mener à des effets négatifs et augmenter ainsi les taux d'ozone.
Précurseurs de l'Ozone
Tout au long de l’année, le trafic, l’industrie et chacun de nous provoquent l’émission de précurseurs de l’ozone dans l’air.
Répartition des précurseurs pour la Belgique:
File:Ozone-belgique-répartition.gif
Production à partir de polluants
Les oxydes d'azote
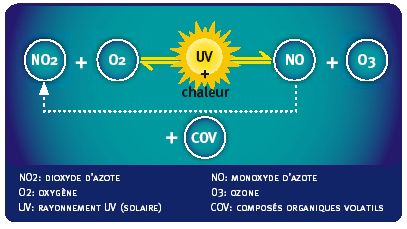
Les différentes réactions entre l'ozone et les oxydes d'azote peuvent se résumer par l'équilibre suivant :
NO2 + O2 + hv <-> O3 + NO
L'ozone est formé par réaction entre le dioxyde d'azote et l'oxygène atmosphérique en présence de radiation solaire. La réaction inverse est possible : l'ozone est détruit par le monoxyde d'azote pour donner du dioxyde d'azote. Si la formation d'ozone est un phénomène lent (plusieurs heures), la destruction par le NO est rapide (quelques minutes).
Il existe un équilibre entre ces réactions de formation-destruction et, dans les conditions normales, le taux d'ozone reste stationnaire. Cet équilibre peut être brisé par la présence de Composés Organiques Volatils (COV5) avec, pour conséquence, une augmentation de la teneur en ozone.
Les variations nycthémérales (c'est-à-dire les variations de concentrations selon un rythme de 24 heures) de l'ozone résultent de cet équilibre. La journée, sous l'influence des rayons solaires, l'ozone est formé à partir du dioxyde d'azote (la destruction continue, mais l'effet global observé est une augmentation de l'ozone). Pendant la nuit, seule la réaction de destruction subsiste et l'ozone diminue en formant une «réserve» de dioxyde d'azote qui pourra reformer de l'ozone le jour suivant.
En été, on observe une augmentation de la concentration d'ozone entre 10 et 21 h, puis une diminution, due au processus de destruction. Les variations d'ozone dépendent de sa destruction plus ou moins forte et, selon le type d'environnement, il existe des différences notables entre ces variations nycthémérales.
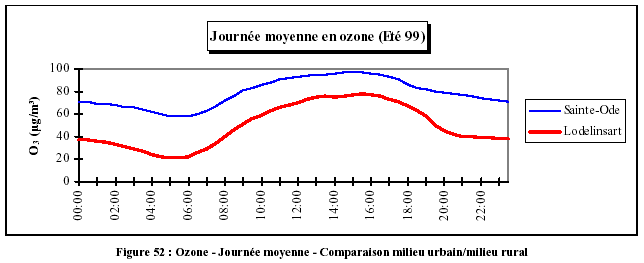
Dans un environnement urbain, la production d'ozone est forte pendant la journée et sa destruction est rapide pendant la nuit. Les pics sont bien marqués, alors qu'en milieu rural et en l'absence de NO, la destruction est plus faible et les variations sont moindres, bien que le niveau général soit plus élevé (ligne de base plus haute).
Dans les agglomérations, les variations de teneurs en ozone sont plus importantes et les valeurs maximales se produisent plus tard dans la journée (14-17 h), contrairement aux stations rurales (12-16 h), la destruction d'ozone retardant l'apparition du maximum. De même, les minima nocturnes sont plus élevés en milieu rural. Lors d'un épisode de smog photochimique, les dépassements ont donc lieu essentiellement l'après-midi (Figure 53).
L'augmentation des concentrations en ozone la journée s'accompagne d'une diminution des concentrations en dioxyde d'azote (Figure 54).
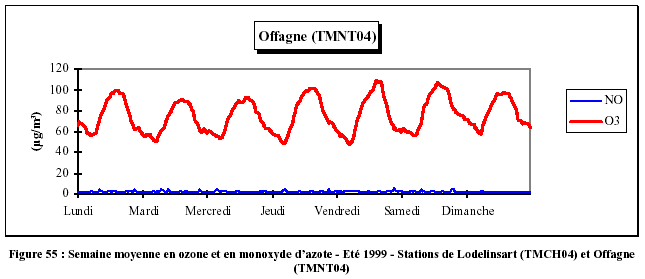
Les concentrations en ozone varient également selon le jour de la semaine (Figure 55). En milieu urbain (Lodelinsart), les concentrations en monoxyde d'azote sont plus fortes et, par conséquent, les concentrations en ozone plus faibles que pour une station rurale (Offagne). En milieu urbain, les maxima en ozone sont plus élevés les week-ends. Le samedi, il y a formation abondante d'ozone en raison de l'influence des émissions de circulation relativement élevées de la veille, la destruction étant inférieure à cause de la réduction de l'intensité de la circulation. Le dimanche, la formation d'ozone est inférieure vu la circulation moins abondante du samedi, tandis que sa destruction est inférieure ou du même ordre que le samedi. Le maximum du dimanche est alors plus faible que celui du samedi. Pour les mêmes raisons, les maxima du week-end ont lieu plus tôt dans la journée.
Aux premières heures de la matinée, l'ozone est en diminution. Ce creux est bien plus marqué pour un milieu urbain et pour les jours ouvrables, en raison du pic important de la concentration en monoxyde d'azote (pic de l'heure de pointe).
L'analyse de la différence entre les concentrations mesurées les jours ouvrables et les week-ends montre qu'une limitation des émissions d'oxydes d'azote (comme par exemple une interdiction de la circulation) peut, à très court terme, entraîner une augmentation de la concentration en ozone.
Les Composés Organiques Volatils (COV5)
Les Composés Organiques Volatils jouent un rôle important dans le schéma de réaction de l'ozone. Dans la couche de mélange, l'ozone est formé par réaction entre une molécule d'oxygène et un atome d'oxygène provenant de la photolyse du dioxyde d'azote (la dissociation d'une molécule d'oxygène requiert des rayons UV plus énergétiques et n'a lieu que dans la stratosphère) :
NO2 + hv -> O + NO ( hv < 242nm) O + O2 -> O3
L'oxygène atomique peut aussi réagir avec une molécule d'eau pour donner des radicaux hydroxyles (OH) :
O + H2O -> 2OH
Si la réaction avec l'eau atmosphérique est la principale source de radicaux hydroxyles OH, d'autres substances peuvent également donner naissance à ces radicaux : photolyse de l'acide nitreux, du formaldéhyde ou du peroxyde d'hydrogène.
Vers la fin des années 70, il a été découvert une autre espèce radicalaire jouant un rôle important dans la chimie de la troposphère, le radical nitrate NO3, formé par la réaction :
NO2 + O3 -> NO3 + O2
NO3 et NO2 sont en équilibre avec l'anhydride nitrique :
NO2 + NO3 -> N2O5
N205 est donc un réservoir de NO3. Le radical NO3 est facilement photolysable et n'a donc qu'une importance la nuit. Il est la principale cause de transformation des composés organiques durant la nuit. Comme sa formation nécessite de l'ozone qui est produit photochimiquement le jour, on parle de "photochimie différée" et même de "photochimie nocturne".
Les radicaux hydroxyles (OH) peuvent attaquer un composé organique volatil (RH); le monoxyde d'azote est transformé en dioxyde d'azote et le radical hydroxyle (OH) est régénéré; le processus peut alors recommencer :
RH + OH + O2 -> R02 + H2O NO + RO2 -> NO2 + RO RO + O2 -> carbonyle + HO2 HO2 + NO -> OH + NO2
Le dioxyde d'azote peut alors subir une nouvelle photolyse menant à la production d'ozone. Chaque espèce radicalaire créée par une réaction est consommée à la suivante et la dernière réaction régénère le radical OH qui peut continuer le processus en chaîne. Ces réactions participent à la conversion de NO en NO2. Le schéma de réaction perturbe l'équilibre entre la production et la destruction d'ozone, en consommant du monoxyde d'azote (diminution de la destruction) et en produisant du dioxyde d'azote (augmentation de la production d'ozone). La photolyse d'une seule molécule de NO2, en donnant deux radicaux hydroxyles, entraîne la production de 2 molécules de NO2 pouvant donner naissance à 2 molécules d'ozone.
A ce schéma, il faut ajouter les réactions de terminaison produisant de l'eau oxygénée de l'acide nitreux et nitrique :
2HO2 -> H2O2 + O2 NO2 + OH -> HNO3 NO + OH -> HNO2 (minoritaire)
Tous les radicaux décrits ont une durée de vie excessivement courte; ils naissent et meurent pratiquement au même endroit. Leurs concentrations restent très faibles (de 1 à 2.106 cm-3 pour les hydroxyles).
Les mécanismes réactionnels seront différents suivant la teneur en NO : aux hautes teneurs, la photo-oxydation des COVs produit de l'ozone; par contre, aux faibles concentrations en NO, un mécanisme consommant de l'ozone peut se développer.
Il existe une grande quantité de composés non émis dans l'atmosphère et résultant de processus photochimiques. Un des plus importants est le nitrate de peroxyacétyle (PAN) qui provient de la dégradation des aldéhydes.
Une même chaîne carbonée peut subir plusieurs décompositions suivant sa structure. Tous les composés carbonés n'ont pas la même réactivité vis-à-vis des radicaux hydroxyles et tous n'auront donc pas le même effet sur les concentrations en ozone. En règle générale, on considère que les composés insaturés (alcènes, aromatiques, ...) ont une réactivité supérieure et un impact plus grand sur l'ozone :
• Les alcanes. Ils présentent une réactivité modérée avec les radicaux OH, faible avec les radicaux NO3 et presque nulle avec l'ozone. Leur dégradation conduit toujours à la formation d'ozone. • Les alcènes. Ils réagissent de manière notable avec les radicaux OH, NO3 et l'ozone.
• Les alcynes. Leur réactivité a été beaucoup moins étudiée, car ils sont peu émis dans l'atmosphère. Ils réagissent principalement avec les radicaux OH, les réactions avec l'ozone et les radicaux NO3 sont négligeables. • Les diènes et polyènes. Ils sont très abondants dans les émissions biogéniques (terpènes, isoprène, ...). Ils sont extrêmement réactifs avec les radicaux OH, NO3 et l'ozone.
• Les composés aromatiques. Ils réagissent principalement avec les radicaux OH, peu avec l'ozone et les radicaux NO3. • Les composés carbonylés. Ils constituent la première étape d'oxydation des COVs.
• Les acides carboxyliques. Ils sont très peu réactifs. Seule la dégradation avec les radicaux OH a lieu, mais est lente. • Les alcools. Ils réagissent peu avec les radicaux NO3 et pratiquement pas avec l'ozone. Ils sont dégradés par réaction avec les radicaux OH.
• Les éthers. Leur réactivité avec les radicaux NO3 et l'ozone est faible. Seule la réaction avec les radicaux OH semble jouer un rôle. • Les amines. Ces composés sont peu présents dans l'atmosphère et détruits par les radicaux OH.
• Les chlorofluorohydrocarbures (HCFC). Ces composés ont été introduits pour remplacer les CFC, nocifs pour la couche d'ozone. Leur réactivité est modérée et ils sont dégradés par les radicaux OH.
L'analyse des interactions entre la pollution photochimique et les Composés Organiques Volatils pour la Région wallonne semble encore prématurée, car nous ne disposons actuellement que de mesures d'hydrocarbures totaux. La mise en place du réseau COVs devrait apporter des renseignements intéressants quant à la chimie de ces composés.
Autres composés
L'ozone est un gaz extrêmement réactif et il peut interagir avec une quantité de composés. Ces réactions seront abordées dans les chapitres relatifs à ces autres polluants, comme par exemple le monoxyde de carbone.
Stratégie de lutte
La lutte contre la pollution photochimique est un problème complexe, dont la solution est loin d'être évidente. Ainsi, depuis des années, les Américains ont testé différentes politiques, sans obtenir de résultats vraiment satisfaisants. La difficulté de la lutte provient d'un double constat :
- La nature transfrontalière de l'ozone. Les zones à fortes concentrations en ozone ne sont pas nécessairement les zones à fortes émissions des polluants précurseurs et les actions doivent être coordonnées au niveau international.
effet contraire au but recherché et entraîner l'augmentation des teneurs en ozone. Ainsi, la diminution des oxydes d'azote peut entraîner à court terme une augmentation des taux d'ozone (ce qui apparaît lors des week-ends).
La formation des oxydants photochimiques ne peut être influencée que par un changement de l'émission des précurseurs. En cas d'épisodes de pollution, une interdiction de la circulation motorisée apparaît, à court terme, comme préjudiciable, les activités en plein air risquant d'augmenter (vélo, ...) exposant ainsi un plus grand nombre de personnes. De plus, la diminution des précurseurs n'entraîne pas une diminution proportionnelle de l'ozone et le comportement de ce polluant peut varier selon les régions.
Il est également nécessaire de bien connaître les sources de précurseurs. Si le trafic apparaît comme une source importante (surtout en été) pour les oxydes d'azote et les COVs, les émissions d'origine naturelle ne doivent pas être négligées.
Le rôle respectif des NOx et des COVs dans l'impact d'une mesure de restriction des émissions dépend des rapports entre ces précurseurs : si COVs/NOx > 15, les composés organiques sont dominants, une réduction des COVs sera inopérante et seule une réduction des NOx est efficace; si 4 < COVs/NOx < 15, les réductions des émissions des COVs et des NOx ont un
- La non-linéarité. La formation d'ozone dépend du rapport entre deux polluants primaires; la diminution d'un des précurseurs peut avoir un
effet bénéfique sur les concentrations en ozone. si COVs/NOx < 4, les concentrations en ozone augmentent si les concentrations en NOx diminuent; il faut donc ne diminuer que les émissions de COVs.
Il est donc nécessaire d'adapter les mesures réglementaires au milieu où elles doivent s'appliquer. Paradoxalement, les mesures les plus efficaces portent sur le composé le moins abondant.
Ces considérations impliquent qu'il est difficile d'élaborer une stratégie de lutte efficace. Il est cependant certain que si des mesures sont nécessaires, les décisions doivent être concertées à un niveau international.
Actuellement, il n'y a pas de stratégie d'action sur les émissions en cas d'épisodes de pollution. Seule l'information du public permettant de prévenir son exposition est réalisée.
Influence des paramètres atmosphériques
L'ozone est un gaz très réactionnel. Des études ont montré qu'il pouvait être détecté sur des distances moyennes de l'ordre de 50 km en aval des agglomérations importantes. Les molécules d'ozone détectées dans ces zones ne sont cependant pas forcément celles qui existaient dans la zone urbaine, lors du passage de la masse d'air. L'ozone est impliqué dans des réactions de formation et de destruction. Tant que les conditions météorologiques, les concentrations en NOx et COV, ainsi que l'ensoleillement le permettent, les deux types de réaction cohabitent. Durant la nuit, seules les réactions de destruction subsistent et la concentration en ozone diminue lentement.
Température
File:Ozone-température-belgique.gif
L'évolution de la concentration en ozone et de la température montre des évolutions parallèles ; le risque de pics d'ozone est d'autant plus grand que la température est élevée. En réalité, les fortes concentrations en ozone ne sont pas dues à une température élevée, mais ces deux paramètres dépendent directement d'un même facteur : l'ensoleillement.
Vent
Direction du vent
Il nèxiste pas de lien direct et simple entre la direction du vent et les concentrations en ozone. Cependant, les masses d'air venant de l'océan sont moins polluées que celles venant du continent. De plus, les conditions d'ensoleillement nécessaires à la formation d'ozone sont souvent associées à des courants chauds d'origine continentale.
Les roses de pollution en ozone pour l'été 1999 (Figure 58) n'indiquent pas de direction privilégiée. Comme l'ozone est un polluant secondaire, la pollution qu'il cause est un phénomène d'ensemble : il n'existe pas de sources bien localisées.
Vitesse du vent
La vitesse du vent joue un rôle important sur les conditions de dispersion (Figure 59). Au niveau des fortes concentrations, on remarque une augmentation jusqu'à des vitesses de vent atteignant 4 à 6 mis, puis la tendance s'inverse et les concentrations semblent diminuer à mesure que la vitesse du vent augmente. La diminution est facile à comprendre par une plus grande turbulence, donc une meilleure dilution de l'ozone. L'augmentation des concentrations avec la vitesse du vent peut s'expliquer par un apport de polluant, provenant de couches plus élevées de l'atmosphère, durant une
période de forte turbulence. Cette hypothèse permet également d'expliquer la raison de l'absence de concentrations faibles pour des vitesses de vent élevées.
La vitesse du vent n'est qu'un des paramètres influençant les concentrations en ozone et ne constitue pas en soi une condition suffisante : il peut y avoir des fortes vitesses de vent sans pour autant enregistrer des fortes concentrations en ozone.
Une autre manière de présenter les résultats consiste à classer les concentrations en ozone en fonction de la vitesse du vent (Tableau 37 et Figure 60). De nouveau, on remarque la diminution de la proportion de valeurs élevées en ozone avec la vitesse du vent, grâce à une meilleure dilution.
La proportion de valeurs faibles en ozone diminue également pour les classes de vitesses de vent élevées au profit des concentrations intermédiaires pour des raisons déjà évoquées plus haut.
Autres paramètres
Il existe d'autres paramètres météorologiques influençant les taux de concentrations en ozone. Ainsi, par exemple, la nébulosité ou l'hygrométrie modulent l'intensité des rayonnements solaires par absorption UV par les molécules d'eau.
Effets de l'Ozone
Les effets de l'ozone portent surtout sur le système respiratoire.
Les concentrations en ozone varient en fonction des conditions météorologiques et des niveaux de pollution en COVs et NOx de la zone concernée. A titre d'exemple, alors que le niveau général de l'ozone est resté très élevé, on peut trouver dans une rue "canyon" des concentrations faibles, phénomène dû à la destruction locale de l'ozone par le NO émis par le trafic.
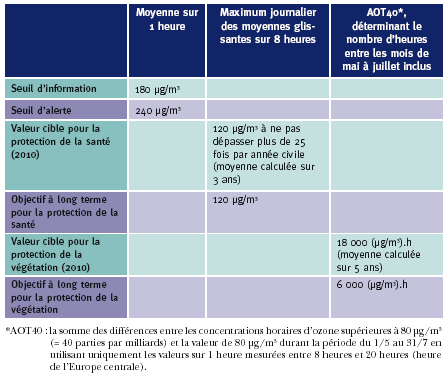
Normes
L’Union européenne établit des directives qui doivent être transposées dans la législation des Etats membres dans un délai déterminé. La directive 2002/3/CE (qui remplace la directive 92/72/CEE) concerne la pollution par l’ozone et impose des valeurs cibles pour la protection de la santé publique et la protection de la végétation. Elle harmonise l’échange d’informations et indique quand la population doit être avertie (ou même mise en garde) de dépassements de concentrations d’ozone déterminées.